Физико-химические свойства глинозема
Прежде чем перейти к характеристике отдельных процессов получения (извлечения) чистой окиси алюминия из руд, необходимо кратко ознакомиться с некоторыми физико-химическими свойствами глинозема, определяющими поведение его в этих процессах.
Полиморфизм глинозема. Полиморфизм, мак известно, представляет собой способность одного и того же вещества образовывать различные типы кристаллической (пространственной) решетки — давать полиморфные разности, обладающие нередко глубоким различием в свойствах.
Для безводной окиси алюминия обнаружено несколько полиморфных разностей, из которых, однако, безусловно установлены, хорошо изучены и имеют большое значение в производстве глинозема две, которые мы и рассмотрим ниже,
Первая из них – a—Al2O3 или корунд, известна с давних времен и является единственной формой безводной окиси алюминия, встречающейся в естественных горных породах в виде бесцветных или окрашенных небольшими примесями других окислов кристаллов (рубин, сапфир). Чистый расплавленный глинозем во время остывания кристаллизуется в форме a—Al2O3. Все виды гидратов окиси алюминия при нагревании до 1200° также превращаются а a—Al2O3. Кристаллизуется корунд в гексагональной системе, причем внешний вид кристаллов обычно веретенообразный или бочкообразный (фиг. 9). Корунд отличается высокой твердостью, занимая в минералогической шкале Мооса предпоследнее перед алмазом место — 9. Он практически не гигроскопичен и имеет наибольший удельный вес из всех полиморфных разностей Al2O3—3,9—4,0.
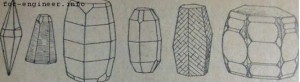
Кристаллические формы корунда
Вторая полиморфная разность безводной окиси алюминия — y—Al2O3, открытая Ульрихом в 1925 г., кристаллизуется в кубической системе (размер ребра куба элементарной кристаллической ячейки — 7,90 * 10-8 см) в характерных октаедрических формах. В природе y—Al2O3 не встречаемся и образуется при обезвоживании трехводной окиси алюминия — гидр аргиллита в температурном интервале 500 — 900°. Отличается большой дисперсностью и гигроскопичностью. Удельный вес y—Al2O3 — 3,77. При нагревании выше 900° y—Al2O3 начинает превращаться в a—Al2O3, что полностью завершается при 1200°.
Водная окись алюминия известна в виде следующих стабильных форм: диаспора, бемита и гидраргиллита.
Диаспор и бемит являются полиморфными разностями одноводной окиси алюминия и отвечают химическому составу метаалюминиевой кислоты (НAlO2):
Al2O3* H2O=2AlOOH=2 НAlO2
Как диаспор, так и бемит встречаются в виде природных минералов, входя в состав бокситов. Бемит образуется также при обезвоживании гидраргиллита при 250°. Оба кристаллизуются в ромбической системе, отличаясь друг от друга показателями преломления. Обычной формой кристаллов диаспора являются плоские призмы. При нагревании до 500° диаспор и бемит полностью теряют кристаллизационную воду, превращаясь в безводную окись. Однако характер процесса обезвоживания для диаспора и бемита не одинаков. Кривая обезвоживания диаспора показывает, что дегидратация этого минерала происходит полностью в температурном интервале 410—450° и является линейной функцией температуры. Кривая же обезвоживания бемита имеет другой вид и состоит из двух характерных участков. Первый из них лежит между 300 и 450° и имеет форму гиперболической кривой. В этом температурном интервале удаляется только примерно 25% кристаллизационной воды бемита. Второй участок находится между 450 и 490° и соответствует более интенсивному обезвоживанию, аналогичному для диаспора. Таким образом, если удаление связанной воды для диаспора заканчивается полностью при 450°, то для бемита этот процесс только начинается, оканчиваясь, примерно, при 500°. Для смесей диаспора и бемита кривые их обезвоживания занимают промежуточное положение. При обезвоживании диаспор превращается непосредственно в a—Al2O3, а бемит —- сначала в y—Al2O3.
Гидраргиллит, или гибсит, является, по-видимому, единственной формой трехводной окиси алюминия. Полиморфной разности для нее не обнаружено, Гидраргиллит отвечает химическому составу ортоалюминиевой кислоты (Н3А1О3): Al2O3*3 H2O=2А1(ОН)3=2 Н3А1О3. Встречается в природе как минерал и входит в состав бокситов. Кристаллизуется в моноклинной системе в виде табличек. Представляет собой конечную форму кристаллической гидроокиси алюминия, выпадающей из алюминиевых растворов при низких температурах. Гидраргиллит, обезвоженный при 250°, теряет две молекулы кристаллизационной воды, превращаясь в бемит.
В соответствии с изложенным различные формы окиси и гидроокиси алюминия индивидуальной кристаллической решеткой могут быть классифицированы в два полиморфные ряда (ряды Габера) — a — ряд и y — ряд.
a — ряд | y — ряд |
Отсутствует Al(OH)3 | Гидраргиллит Al(OH)3 |
Диаспорит AlOOH | Бемит AlOOH1 |
Корунд a—Al2O3 | y—Al2O3 |
В обоих рядах приведены лишь конечные стабильные формы. Вообще же среди гидратных форм окиси алюминия наблюдаются промежуточные образования, стремящиеся к этим стабильным формам. Так, при определенных условиях из алюминиевых солей в щелочной среде гидроокись алюминия вначале выделяется в форме байерита, который затем переходит в гидраргиллит. Аммиак осаждает гидроокись алюминия в аморфной форме.
Температура плавления и кипения глинозема. Безводный глинозем является термически стойким окислом, отличаясь высокой температурой плавления и кипения. Температура плавления a—Al2O3 равна 2050°. Температура же кипения безводной окиси алюминия при атмосферном давлении составляет 2980°.
Теплота образования глинозема. Безводная окись алюминия — весьма прочное соединение. Теплота образования ее значительно выше теплот образования основных примесей, входящих в состав алюминиевых руд. Это обстоятельство позволяет выделять окись алюминия из руд как таковую (в виде корунда) или же в форме шлаков, восстанавливая углеродом примеси до элементарного (металлического) состояния. Сама же окись алюминия в этих условиях восстанавливается до металла лишь ,в ничтожной степени.
Рот, Вольф и Фриц в 1940 г. Сжиганием электролитически-рафинированного алюминия определили теплоту образования Al2O3 при 22° равной 402 ± 0,3 б. кал/г-мол. Для сравнения укажем, что для SiO2 и ТiO2 эти величины соответственно составляют 208 и 225 б. кал/г-мол.
Химические свойства глинозема. Глинозем является типичным амфотерным химическим соединением, основные и кислотные свойства которого выражены, примерно, в одинаковой степени. Существуя в трехводной и одноводной формах, гидроокись алюминия, как мы указывали выше, может соответственно рассматриваться в первом случае, как трехосновная ортоалюминиевая кислота (Н3AlO3) и во втором случае, как одноосновная метаалюминиевая кислота (НAlO2).
Благодаря своему амфотермому характеру, глинозем может растворяться и в кислотах и в щелочах. Наименьшей растворимостью обладает при этом a—Al2O3; более растворим y—Al2O3, Особенно же легко растворяется (гидроокись алюминия, причем по возрастанию интенсивности растворения в едком натре различные формы ее могут быть расположены в следующий ряд:
Диаспор — бемит — гидраргиллит.
В растворах кислот гидроокись алюминия ведет себя как основание, образуя алюминиевые соли соответствующих кислот, например:
2Al(OH)3+3H2SO4= Al2(SO4)3 +6H2O.
В растворах же оснований гидроокись алюминия проявляет себя как кислота, образуя щелочные соли этой кислоты алюминаты, например:
2Al(OH)3+NaOH=NaAlO2+2H2O.
При высокой температуре с сульфидами тяжелых металлов в присутствии восстановителя окись алюминия дает сульфид алюминия, плавящийся при 1100°:
Al2O3+3FeS+3C=Al2S+3Fe+3CO.
С азотом при высокой температуре окись алюминия образует соответственно нитрид алюминия:
Al2O3+3C+N2=2AlN+3CO.
Наконец, при высоких температурах окись алюминия с соединениями щелочных и щелочно-земельных металлов образует также соответствующие алюминаты, например метаалюминат наnрия — Na2O*Al2O3 (с температурой плавления 1650°) или метаалюминат кальция СаО*Al2O3 (с nемпературой плавления 1600°), которые играют большую роль в промышленных методах производства глинозема.